Видяхме, че според атомната теория атомите са малки частици, но въпреки това притежават маса. Говорихме също за масовото число като сумата от масата на протоните и неутроните. Но не можем да измерим масата на атомите. Затова учените намериха по-прост начин да представят масата на атомите, сравнявайки я с масата на атом на избран елемент, взет за стандарт.
Относителна атомна маса
По този начин се получава безразмерна величина, която се нарича относителна атомна маса. По време на развитието на науката за сравнение бяха избрани масите на атомите на различни елементи. Днес е приета унифицираната единица за маса или т.нар въглеродна единица (понякога наричана единица за атомна маса). Тази единица се дефинира, както следва: Единната единица за маса представлява 1/12 от масата на въглеродния изотоп 12C и се обозначава с латинската буква u.
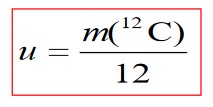
Стойността на унифицираната единица за маса е 1,66∙10-27 kg. Можем да интерпретираме това определение на унифицираната единица за маса по следния начин. Масовото число на изотопа 12 C показва, че в ядрото на този изотоп има 6 протона и 6 неутрона. Ако тази маса се раздели на 12, всъщност ще получим средната маса на един нуклон, тоест един протон или неутрон.
Така че, вместо действителните маси на атомите, ще използваме относителните атомни маси. Относителната атомна маса се означава с Ar и се определя по следния начин: Относителната атомна маса е съотношението между средната маса на атома на елемента и унифицираната единица за маса.

Относителната атомна маса показва колко пъти средната маса на един атом е по-голяма от въглеродната единица и е неназовано число. Ще получим истинската маса на атома, ако умножим относителната атомна маса по унифицираната единица за маса. Това ще бъде обсъдено малко по-късно.
Относителните атомни маси са дадени в периодичната таблица на елементите. Но както виждате, почти всички относителни атомни маси са десетични числа. защо е така Както беше посочено по-рано, повечето елементи се срещат като смеси от изотопи. В такъв случай относителната атомна маса на природния елемент е сумата от произведенията на относителните атомни маси на отделните изотопи и техните молни (количествени) дялове.
Относителна молекулна маса
Повече за това ще бъде обсъдено в по-нататъшното ви изучаване на химия. Молекулите, подобно на атомите, са много малки частици, така че е добре да представим тяхната маса подобно на масата на атомите. За молекулите е въведена относителната молекулна маса Mr. Но освен съединения, съставени от молекули, казахме, че има и съединения, съставени от йони, така че в такъв случай не говорим за молекули, а за формулни единици.
Затова освен относителна молекулна маса е въведен и терминът относителна формулна маса. Всъщност в повечето случаи тези два термина се свеждат до термина относителна молекулна маса, но разбира се, трябва да имаме предвид, че има и такива съединения, които не са съставени от молекули.
Подобно на това как се определя относителната атомна маса, може да се определи и относителната молекулна маса (относителна формулна маса). И така: Относителната молекулна (формула) маса представлява съотношението между масата на молекулата (т.е. формулната единица) и унифицираната единица за маса.
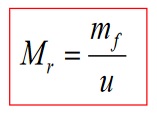
В това уравнение mf представлява формулната маса на съединението. От самите изрази за относителна атомна маса и относителна молекулна маса следва, че те са безразмерни величини, каквито са всъщност всички т.нар. относителни величини.
Tags: Атомна, Маса, Молекулна, Относителна, Формула

 Моля Изчакай...
Моля Изчакай...