Какво представляват молекули? Освен атома в изграждането на веществата участват още два вида частици. Една от тези частици се получава, когато електрони от най-високото енергийно ниво при определени условия напуснат атома или когато малък брой други електрони се присъединят към това енергийно ниво. И в двата случая се получават заредени частици, т.нар йони.
Молекули
Видяхме, че електроните в най-високото енергийно ниво, т.е. в най-външния електронен слой от ядрото те имат по-висока енергия от останалите електрони, тъй като се държат по-слаби от електростатичните сили с положително зареденото ядро. Тези електрони се наричат валентни електрони. Те, както ще видим, участват в образуването на химични връзки.
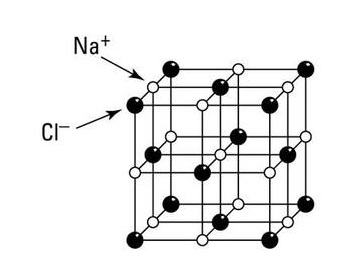
При определени условия атом на даден елемент може да изпусне валентните си електрони. В такъв случай броят на протоните в ядрото ще бъде по-голям от броя на електроните в електронната обвивка, така че получената частица ще бъде положително заредена. И така, положително заредените йони, наречени катиони, се получават от атоми по този начин.
Аниони
В други случаи атомът на даден елемент може да получи определен брой електрони, поради което броят на електроните в електронната обвивка ще стане по-голям от броя на протоните в атомното ядро. По този начин от атомите се получават отрицателно заредени йони, наречени аниони. Така че:
Катионите са положително заредени йони, а анионите са отрицателно заредени йони. Броят на изпуснатите или получените електрони зависи от броя на валентните електрони и максималния брой електрони, които може да съдържа най-високото енергийно ниво.
Катиони
Както видяхме по-рано, това число е 2 за първия слой, 8 за втория и 8 за третия. Ако, например, два електрона бъдат изпуснати от атом на елемент, относителният заряд на получения катион ще бъде 2+ и ако атомът получи, да речем, три електрона, относителният заряд на получения анион е 3–. Зарядите на катионите и анионите се изписват като горен десен индекс до символа на елемента, първо числовата стойност, след това знака + или –. Например: Ca2+, K+, Al3+, Cl–, O2–, N3– и др.
Както сте научили преди и ще научите по-нататък, йоните се свързват един с друг и образуват съединения. Съединенията, образувани от противоположно заредените йони, са представени от т.нар формулни единици, за които повече ке ще се говори, когато ще се изучават химичните връзки.
При определени условия атомите могат да се свързват един с друг и да образуват по-сложни частици, които са градивните елементи на голям брой вещества и се наричат молекули. Как, защо и кои атоми се свързват един с друг ще бъде обяснено, когато разгледаме химичните връзки. Сега нека заключим:
Изграждане на материята
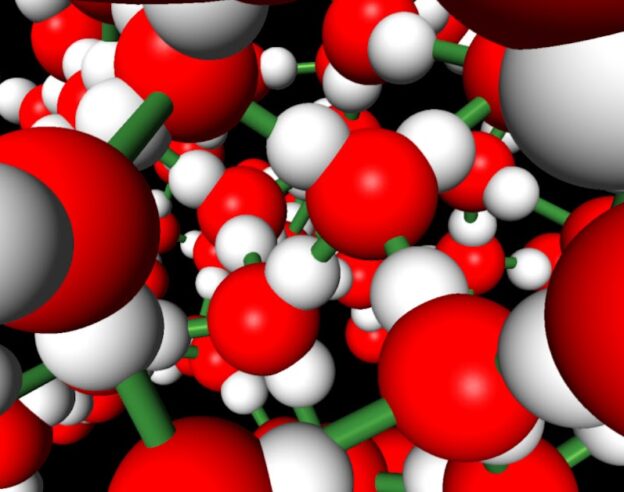
Молекулите са изградени от два или повече атома, свързани помежду си чрез химическа връзка. Молекулите могат да се състоят от два или повече еднакви атома, но броят на молекулите, съставени от различни атоми, е много по-голям.
Освен това има молекули с малък брой атоми в състава си, но има и такива, които съдържат много голям брой, дори до милион или повече атоми. Такива молекули се наричат макромолекули. Има естествени макромолекули, като например протеини, нишесте, целулоза и др., Но голям брой макромолекули са синтезирани от човека.
Пластмасовите материали, синтетичните текстилни влакна и много други, синтезирани от човека, се състоят от молекули със специфични свойства, които се използват широко в бита и техниката. Записваме молекулите с химични формули и често ги представяме с модели. Най-често използваните молекулярни модели са т.нар модели на топка и пръчка и модели на калот.
И накрая, можем да кажем, че градивните елементи на веществата са атоми, молекули и йони.

 Моля Изчакай...
Моля Изчакай...