Последната от четирите групи неорганични съединения е групата на солите. В същото време това е най-голямата група неорганични съединения, а освен това е и най-често срещаното в ежедневието на човека.

Използваме малко соли хранене, други като лекарства, а голяма част от тях намират приложение в селското стопанство и индустрията. Както при другите групи съединения, и в тази група нейните членове са свързани помежду си, т.е. имат някои общи свойства. Дотук споменахме няколко соли. Нека да разгледаме формулите на някои от тях.
Формули на соли
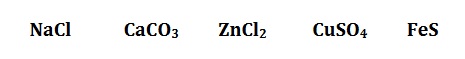
Очевидно е, че солите се състоят от метал (в тези примери това е Na, Ca, Zn, Cu, Fè) и киселинен остатък (например от киселините HCl, H 2CO3, H 2SO4 и H 2S). Когато обаче говорихме за хидроксиди, споменахме и амониеви соли, т.е. споменахме амониев хлорид, NH 4Cl, и амониев нитрат, NH 4NO3. За да дефинираме солите, освен техния състав, ще споменем още едно тяхно важно свойство. А именно, във водни разтвори солите се разпадат (дисоциират) на метални катиони (или амониеви катиони, ако са амониеви соли) и аниони от киселинния остатък. Можем да го представим със следните примери:
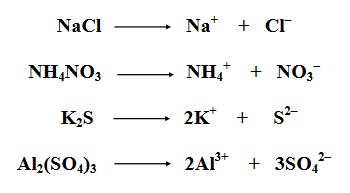
Вече можем да дадем по-пълна дефиниция на това какво представляват солите. А именно, солите са съединения, които се състоят от метал (или амониева група) и киселинен остатък. Във водни разтвори те се разпадат (дисоциират) на катиони на метала или амониеви катиони и аниони на киселинния остатък.
Видове соли
Солите могат да бъдат разделени по различни начини, но разделението се основава и на техния състав. Ако разглеждаме солите като съединения, в които водородните атоми от киселината са заменени с метални атоми, то те могат да бъдат разделени на т.нар. нормални соли и водородни соли. Нормалните соли са тези, получени, когато всички водородни атоми от киселината ще бъде заменена с метални атоми. В такива соли няма водород в киселинния остатък.
Нормални соли
Примери за нормални соли са: NaCl, CaCO3, ZnCl2, K 2SO4, NH 4NO3, Al(NO3)3, MgSO 4 и много други.
Водородни соли
Водородните соли са тези, които съдържат един или повече водородни атома в киселинния остатък. Примери за водородни соли са: NaHCO3, Fè 2(HPO4)3, KHSO4, Mg(HCO3)2, Al(HSO4)3, Cu(HS) 2, Ca(HCO3)2 и др.

Хидроксидни соли
Има и т.нар хидроксидни соли. Тези соли съдържат хидроксидна група(и) в състава си. Такива соли са например: Ca(OH)Cl, Mg(OH)NO3, Bi(OH)2Cl и др.
Двойни или смесени соли
Понякога в състава на солите могат да бъдат включени два различни метала (т.е. катиони) или два различни киселинни остатъка (аниони). Такива соли се наричат двойни или смесени соли. Ето някои такива соли: KNaSO4, CaCl(ClO) Mg(NH 4)PO4 и други.
Кристални хидрати
Голям брой соли, получени от водни разтвори, съдържат една или повече водни молекули в състава си. Такива соли се наричат кристални хидрати. Има много примери за кристални хидрати. Ето няколко: Na 2CO3·10H 2O, FèSO4·7H 2O, CuSO4·5H 2O, CaSO4·2H 2 O, Co(NO3)2·6H 2O и други.
Tags: Видове, Водородни, Двойни, Кристални, Нормални, Смесени, Соли, Хидрати, Хидроксидни


 Моля Изчакай...
Моля Изчакай...