Вода е вещество, което ни е добре познато. Това е най-важното съединение за човешкия живот. Пием вода, мием се с нея, плуваме в нея, мием се и чистим с нея и т.н. Освен че е най-важното съединение, то е и най-разпространеното съединение на Земята, но и в човешкото тяло, където е
представляват 60-70 %.
За да разберем защо водата е толкова важна, трябва да знаем нейните свойства. Както ще видим, това е съединение с най-необичайните и уникални свойства от всяко съединение, познато на човека. Вече знаете, че водата в природата съществува в течно, твърдо и газообразно състояние. На Земята се среща в океани, морета, езера, реки и подпочвени води, ледници и др. А именно, около 2/3 от повърхността на нашата планета е покрита с вода, а в атмосферата има големи количества вода под формата на водна пара, мъгла и облаци.
Кръгов цикъл на водата в природата
Топлината от Слънцето кара водата да се изпарява от океаните, моретата, езерата и реките, образувайки водна пара, която кондензира в малки капчици високо в атмосферата. Когато капките станат достатъчно големи, водата пада на земята като дъжд, градушка, сняг, киша, мъгла или роса. Част от водата преминава под повърхността на земята, образувайки подземни води, които на места извират от земята, а на други се вливат в повърхностните води. Този кръговрат се извършва постоянно и с него се осигурява необходимото количество вода на Земята.

По своя химичен състав водата е просто съединение, изградено от елементите водород и кислород, чиято химична формула е Н2О. Както беше посочено по-рано, съставът на водата може да бъде потвърден чрез електролиза на вода, която произвежда две газообразни вещества: кислород и водород. Водородът се отделя с два пъти повече от кислорода. От друга страна, водата може да се получи чрез директен синтез от водород и кислород, съгласно следното уравнение:
Чистата вода е бистра, безцветна, лесно подвижна течност, без мирис и вкус, с плътност 1 kg/dm3, т.е. 1 g/cm3. По-рано казахме, че при нормално атмосферно налягане (около 105 Pa) водата замръзва при 0 °C и кипи при 100 °C. Всъщност тази точка на кипене е необичайно висока за съединение с толкова ниска относителна молекулна маса (Mr =18).
Температурата на кипене зависи от молекулната маса и от взаимодействията между частиците, които, колкото са по-силни, толкова по-висока е температурата на кипене. Това означава, че основната причина за високата температура на кипене на водата са силните взаимодействия между нейните молекули. А именно, между полярните водни молекули действа специален тип взаимодействие, известно като водородна връзка, за което ще научите повече по-късно.
В допълнение към високата точка на кипене, водата има и много висок топлинен капацитет. Без да навлизаме в много подробности за тази величина, само ще споменем, че тя показва колко се променя температурата на системата при топлообмен с околната среда. Високият топлинен капацитет на водата показва, че тя може да обменя голямо количество топлина със заобикалящата я среда, без да променя драстично температурата си.
Водна аномалия
Като се има предвид, че човешкото тяло се състои от 60-70% вода, именно високият топлинен капацитет е причината за постоянната телесна температура както когато сме изложени на по-високи температури от тялото, така и когато сме изложени на по-ниски от него . Освен това високият топлинен капацитет на водата е причина за малките температурни промени между дневната и нощната температура в местата в близост до големите водни басейни.
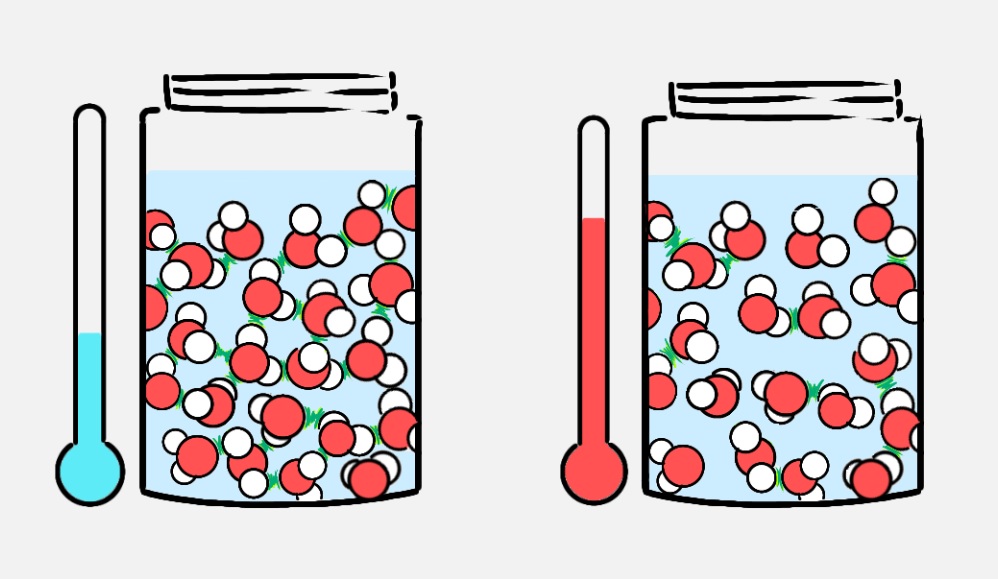
Може би най-необичайното свойство на водата е т.нар водна аномалия. При температура +4 °С водата има най-висока плътност (1 g/mL). При по-ниска температура обемът на водата се увеличава, а плътността намалява. Така ледът има по-голям обем от същата маса течна вода, което означава по-ниска плътност.
Водните молекули в леда са на по-голямо разстояние една от друга, отколкото в течната вода. Всички други вещества се държат по обратния начин (в твърдо агрегатно състояние веществата имат по-висока плътност, отколкото когато са в течно състояние). Ето защо това свойство на водата се нарича водна аномалия.
Тъй като е “по-лек” (по-малко плътен), ледът плува по повърхността на водата и предотвратява замръзването на водата под него. Това свойство на водата е много важно за поддържането на живота в естествени води при ниски температури. От друга страна, това свойство на водата е причина за потъването (ерозията) на скалите и спукването на водопроводи, а в миналото и за инциденти, когато кораб се удари в айсберги, плаващи на повърхността на морето, т.к. например тази, където потъна Титаник.

Разтваряне на различни вещества във вода
Свойството на водата да разтваря различни вещества и в трите агрегатни състояния е добре известно на човека. Водата е един от най-добрите разтворители. В същото време това е най-безопасният разтворител за работа. Тъй като разтваря толкова много различни вещества, понякога се казва, че водата е „универсалният разтворител“.
Въпреки това, няма вещество, което да може да разтвори всички видове вещества. Всъщност само вещества, които са сходни по своята химическа структура (типа химични връзки, от които са направени), могат да се разтварят едно в друго. По този начин, тъй като самата водна молекула е полярна, водата разтваря йонни вещества и вещества, образувани от полярни молекули.
И така: Водата е един от най-добрите разтворители, в който се разтварят йонни вещества и вещества, образувани от полярни молекули. Като разтворител водата е от голямо значение в химическата лаборатория, но е важна и за функционирането на живите организми, тъй като реакциите в човешкото тяло протичат главно във водни разтвори.
При липсата на водни разтвори голяма част от химията на живота не би могла да се осъществи. Има и редица вещества, които не се разтварят във вода. Можете да разберете по-добре разтворимостта/неразтворимостта на различни вещества във вода, ако извършите следния експеримент.
Експеримент
Разтворимост на различни вещества във вода. Необходимо оборудване и вещества: Шест малки лабораторни чаши, стъклена пръчка, захар, сол, пясък, олио, алкохол (спирт), ацетон (лакочистител), предпазни очила и ръкавици. Процедура: Напълнете шест малки лабораторни чаши наполовина с вода. Поставете едно от горните вещества в отделни чаши. От веществата в твърдо агрегатно състояние се слагат по 1 малка чаена лъжичка, а в течно – по 20 мл. С чиста стъклена пръчица смесете съдържанието във всяка от чашите. Наблюдавайте кои от веществата се разтварят във вода и направете таблица, в която ще впишете изводите.
Веществата, които се разтварят във вода, не са еднакво разтворими в равни количества вода. Някои се разтварят повече, а други по-малко. Таблицата показва разтворимостта на различни вещества в 100 g вода.
| Вещество | Грама вещество, разтворено в 100 g вода при 20 °C |
| Захар | 200 |
| Сол | 36 |
| Меден (II) сулфат | 20 |
| Калциев хидроксид | 0,2 |
| Калциев карбонат | 0,006 |
Освен от химичната природа на веществата, разтворимостта зависи и от температурата, а при газообразните вещества и от налягането. За повечето твърди вещества разтворимостта в определена маса вода нараства с повишаване на температурата, но в различна степен. Например, много по-голямо количество захар може да се разтвори в същата маса вода, ако температурата се повиши, което не е случаят със солта, в която с повишаване на температурата се разтваря само малко по-голямо количество.
Водопоглъщане
Освен това има вещества, чиято разтворимост във вода намалява с повишаване на температурата. В газовете разтворимостта се увеличава с намаляване на температурата и повишаване на налягането. Някои вещества имат способността да абсорбират вода (“влага”) от околната среда. Казваме, че те проявяват хигроскопичност, а самите вещества се наричат хигроскопични вещества. Има и вещества, които отнемат вода от други вещества и такива вещества се наричат дехидратиращи агенти.

Спомнете си, че вече споменахме тези свойства със сярната киселина. Някои от тези вещества намират практическо приложение в химическата лаборатория за дехидратиране на различни вещества. Други вещества реагират с водата, променяйки цвета си. Такива са примерите за получаване на кристалохидрати от безводни соли.
Например, ако няколко капки вода се капнат върху безводен CuSO4, който е бял на цвят, се получава оцветен в синьо CuSO 4∙5H 2O. Безводният CoCl2 с вода образува розово оцветен CoCl2∙6H 2O, а безводният NiCl2 с вода образува зелено оцветен NiCl2∙6H 2O и т.н. Такива реакции могат да служат за доказване на наличие на вода в различни течности.
Tags: Аномалия, Вода, Водна, Водопоглъщане, Разтваряне

 Моля Изчакай...
Моля Изчакай...